Ngành dược dần yêu cầu khắt khe về chất lượng, khái niệm tiêu chuẩn EU GMP là gì dần được doanh nghiệp xuất khẩu thuốc quan tâm. Bởi chứng nhận EU GMP được xem là giấy thông hành để các loại thuốc Việt bước chân vào thị trường châu Âu. Bài viết sau, Tesla Express sẽ giúp bạn hiểu rõ EU-GMP là gì, quy trình lấy chứng nhận GMP châu Âu, và lợi ích của chứng nhận này trong thực tế.

Chứng nhận tiêu chuẩn EU GMP là gì
Tiêu chuẩn EU GMP (European Union – Good Manufacturing Practice) là hệ thống nguyên tắc và hướng dẫn do Cơ quan EMA về Quản lý Dược phẩm Châu Âu ban hành. Mục tiêu của chứng nhận này là đảm bảo các sản phẩm dược luôn đồng nhất về chất lượng, mang tính an toàn theo yêu cầu của Liên minh châu Âu.
Việc đạt chứng nhận thực hành sản xuất tốt EU giúp các công ty dược nâng cao uy tín, kiểm soát chất lượng sản phẩm và mở rộng cơ hội xuất nhập khẩu ra thị trường thương mại quốc tế.
Theo Thông tư liên tịch số 36/2013/TTLT-BYT-BTC của Bộ Y tế và Bộ Tài chính, nhà máy dược phẩm đạt tiêu chuẩn EU GMP là cơ sở được cơ quan có thẩm quyền của quốc gia thành viên EMA cấp chứng nhận. Đồng thời, cơ sở đó phải được Cục Quản lý Dược công bố trên trang thông tin điện tử chính thức.
Lợi thế khi nhà máy đạt chứng nhận GMP của EU
Cơ sở sản xuất thuốc đạt tiêu chuẩn EU GMP sẽ có rất nhiều lợi thế trên thị trường thuốc quốc tế, cụ thể như:
- GMP EU giúp tăng cơ hội trúng thầu, theo Thông tư 15/2019/TT-BYT của Bộ Y tế, các doanh nghiệp có nhà máy dược phẩm đạt chứng nhận GMP của EU được ưu tiên đấu thầu vào nhóm thuốc generic nhóm 1 và 2 trong danh mục đấu thầu tập trung.
- Tiêu chuẩn EU-GMP giúp mở rộng cơ hội xuất khẩu và hợp tác quốc tế với những thị trường khó tính như châu Âu, Mỹ, Nhật Bản hay Úc.
- GMP của EU giúp nâng cao chất lượng và độ tin cậy của sản phẩm. Tiêu chuẩn này yêu cầu kiểm soát nghiêm ngặt toàn bộ quy trình chế tạo thuốc giúp tạo ra niềm tin lớn hơn từ khách hàng và đối tác trong và ngoài nước.
- Thực hành sản xuất tốt EU giúp doanh nghiệp gia tăng lợi thế cạnh tranh và vị thế trong ngành thuốc, đây là minh chứng cho năng lực của nhà máy thuốc và cam kết chất lượng ở đẳng cấp quốc tế.
Mời bạn tham khảo thêm bài viết EORI Number là gì để tìm hiểu kĩ giấy tờ cần có cho quy trình xuất khẩu hàng sang châu Âu.
Quy trình lấy chứng nhận EU-GMP cho nhà máy sản xuất dược
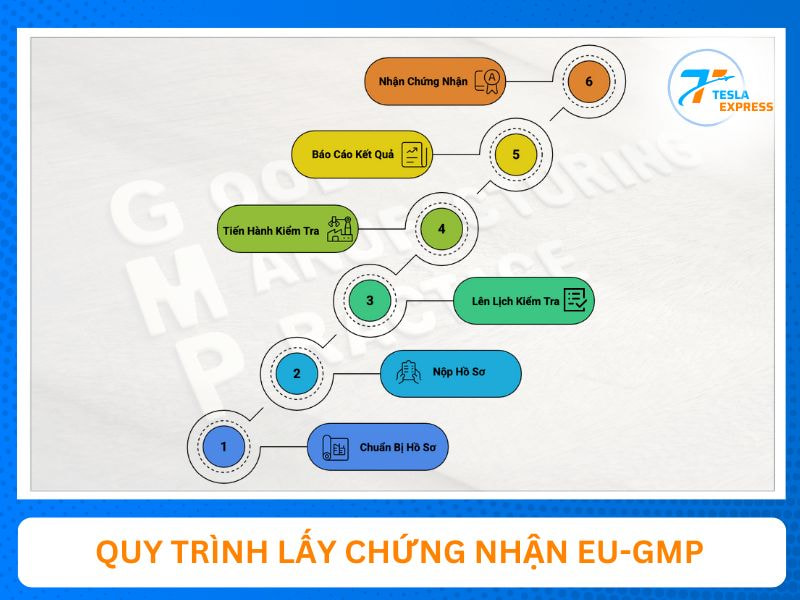
Tesla Express gửi đến bạn quy trình phát hành tiêu chuẩn GMP trong sản phẩm thuốc cho doanh nghiệp như sau:
- Bước 1: Doanh nghiệp cần chuẩn bị đầy đủ hồ sơ pháp lý và đảm bảo nhà máy đáp ứng chuẩn về hạ tầng, quy trình sản xuất, kiểm soát chất lượng theo GMP của EU.
- Bước 2: Hồ sơ xin EU GMP của bạn được nộp đến cơ quan quản lý dược của một quốc gia thành viên thuộc EMA.
- Bước 3: Doanh nghiệp và cơ quan có thẩm quyền sẽ thống nhất lịch hẹn kiểm tra nhà máy dược phẩm.
- Bước 4: Đoàn đánh giá của cơ quan chức năng tiến hành kiểm tra đánh giá toàn diện quy trình, điều kiện vệ sinh, hồ sơ lô,… theo đúng hướng dẫn EU-GMP.
- Bước 5: Cơ quan đánh giá tổng hợp kết quả và lập báo cáo chi tiết về các ghi nhận đạt/chưa đạt của nhà máy.
- Bước 6: Cơ quan chức năng cấp chứng nhận đạt tiêu chuẩn EU-GMP nếu nhà máy dược phẩm của bạn đạt chuẩn.
Mẫu chứng nhận thực hành sản xuất tốt EU
Bên dưới là mẫu giấy chứng nhận GMP Europe chuẩn.

Bạn có thể tải file mẫu chứng nhận EU GMP tại đây.
So sánh GMP WHO và GMP EU trong sản xuất thuốc
GMP-WHO và GMP-EU giống nhau đều là hệ thống quản lý thực hành tốt trong chế tạo thuốc. Cả hai hệ thống này đều dựa trên nền tảng của tiêu chuẩn ISO 9001 về quản lý chất lượng.
GMP của WHO và EU đều quy định rõ vai trò, trách nhiệm của từng bộ phận trong quá trình sản xuất, mục tiêu cuối cùng là tạo ra các sản phẩm thuốc chất lượng, đồng nhất và đạt hiệu quả điều trị cao cho người sử dụng.
Về sự khác nhau của hai tiêu chuẩn này, Tesla Express đã tổng hợp chi tiết ở bảng dưới đây.
| GMP-WHO | GMP-EU | |
| Cơ quan ban hành | Tổ chức Y tế Thế giới (WHO) | Cơ quan Quản lý Dược phẩm Châu Âu (EMA) |
| Phạm vi áp dụng | Trên 100 quốc gia, chủ yếu là các nước đang phát triển | Các nước thuộc Liên minh châu Âu (EU) và các doanh nghiệp ngoài EU nếu muốn xuất khẩu vào châu Âu |
| Mức độ hướng dẫn | Hướng dẫn cụ thể, chi tiết | Hướng dẫn không quá chi tiết nhưng yêu cầu thực hiện nghiêm ngặt |
| Kiểm soát nhiễm | Không yêu cầu kiểm soát quá nghiêm ngặt | Kiểm soát chặt chẽ |
| Kiểm soát chuỗi cung ứng | Ít nhấn mạnh | Đánh giá nghiêm ngặt nhà cung cấp API và toàn bộ chuỗi cung ứng |
| Kiểm soát tá dược | Không yêu cầu kiểm soát sâu | Quản lý nghiêm ngặt chất lượng và nguồn gốc tá dược |
| Áp dụng thực tế | Có thể linh hoạt theo từng quốc gia | Bắt buộc và kiểm tra thực địa kỹ lưỡng |
| Mức độ đánh giá chất lượng tổng thể | Cơ bản – khá | Cao – rất cao, là chuẩn quốc tế hàng đầu hiện nay |
Nếu doanh nghiệp có nhu cầu gửi hàng đi châu Âu giá rẻ, đặc biệt là sản phẩm thuốc. Bạn cần tìm hiểu kĩ tiêu chuẩn EU GMP là gì để quy trình vận chuyển hàng hóa quốc tế diễn ra thuận lợi, tránh rủi ro.
FAQS về tiêu chuẩn thực hành sản xuất tốt của EU
Danh sách nhà máy đạt EU-GMP tiêu chuẩn?
Một vài nhà máy đạt GMP-EU tại Việt Nam gồm: Imexpharm, Stada Việt Nam, Pymepharco, Sanofi Việt Nam, SaVipharm,…
Hiệu lực của chứng nhận GMP-EU bao lâu?
GMP của EU thường có hiệu lực 3 năm, nhưng có thể thay đổi tùy quốc gia cấp chứng nhận và kết quả thanh tra.
Tại sao sản xuất và xuất khẩu thuốc sang châu Âu phải có chứng nhận GMP EU?
Vì thực hành sản xuất tốt EU là yêu cầu bắt buộc để đảm bảo thuốc được chế tạo an toàn, đạt chuẩn chất lượng cao và tuân thủ đúng quy định của EMA.
Các đơn vị cơ quan uy tín liên quan đến tiêu chuẩn EU GMP
Các đơn vị uy tín liên quan đến EU GMP gồm: EMA (Cơ quan quản lý dược phẩm Châu Âu), PIC/S (Tổ chức thanh tra quốc tế về GMP), Cục Quản lý Dược, Bộ Y tế Việt Nam.
Tóm lại, câu hỏi tiêu chuẩn EU GMP là gì trong thủ tục quy trình xuất khẩu sang châu Âu là một câu hỏi vô cùng quan trọng. Chứng nhận này không chỉ là một bộ quy tắc quản lý chất lượng mà còn là cam kết của nhà phát hành thuốc đối với sức khỏe người dùng. Nếu bạn còn thắc mắc hay khó khăn trong việc áp dụng EU GMP, hãy liên hệ ngay cho Tesla Express nhé!



